「投与後」の検索結果
49件:21~25件目を表示
-
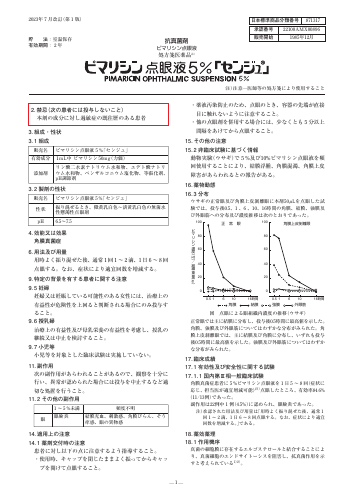
ピマリシン点眼液5%「センジュ」
眼液を頻 回使用することにより、結膜浮腫、角膜混濁、角膜上皮 障害があらわれるとの報告がある。 16. 薬物動態 16. 3 分布 ウサギの正常眼及び角膜上皮剝離眼に本剤50μLを点眼した試 験では、投与後0.5、1 、6 、10、16時間の角膜、結膜、強膜及 び外眼筋への分布及び濃度推移は次のとおりであった。 図 点眼による眼組織内濃度の推移 (ウサギ) 正常眼では主に結膜に分布し、投与後0.5...
https://www.senju.co.jp/system/files/product_other_file/2023-06/pimaricin-5_202307_C1.pdf -

フルオロメトロン点眼液0.02%「センジュ」
隔をあけてから点眼すること。 16. 薬物動態 16. 3 分布 雄性白色ウサギに0.1%の3H-フルオロメトロン懸濁液25μLを点 眼したときの眼組織中濃度を評価した。その結果、Cmaxは角膜 では投与後 5 分に1.99μ g/g、房水では45分に0.16 μ g/gであった。 また、投与後30分の各組織中濃度は、角膜、球結膜、虹彩、強膜 及び房水でそれぞれ1.54μg/g、0.74μg/g、...
https://www.senju.co.jp/system/files/product_other_file/2023-10/fluorometholone-0.02_202312_C4.pdf -

フルオロメトロン点眼液0.1%「センジュ」
隔をあけてから点眼すること。 16. 薬物動態 16. 3 分布 雄性白色ウサギに0.1%の3H-フルオロメトロン懸濁液25μLを点 眼したときの眼組織中濃度を評価した。その結果、Cmaxは角膜 では投与後 5 分に1.99μ g/g、房水では45分に0.16 μ g/gであった。 また、投与後30分の各組織中濃度は、角膜、球結膜、虹彩、強膜 及び房水でそれぞれ1.54μg/g、0.74μg/g、...
https://www.senju.co.jp/system/files/product_other_file/2023-10/fluorometholone-0.1_202312_C4.pdf -

フルオロメトロン点眼液0.05%「センジュ」
隔をあけてから点眼すること。 16. 薬物動態 16. 3 分布 雄性白色ウサギに0.1%の3H-フルオロメトロン懸濁液25μLを点 眼したときの眼組織中濃度を評価した。その結果、Cmaxは角膜 では投与後 5 分に1.99μ g/g、房水では45分に0.16 μ g/gであった。 また、投与後30分の各組織中濃度は、角膜、球結膜、虹彩、強膜 及び房水でそれぞれ1.54μg/g、0.74μg/g、...
https://www.senju.co.jp/system/files/product_other_file/2023-10/fluorometholone-0.05_202312_C4.pdf -

HYALURONATENa_TE_C8_20200509
あけてから点眼すること。 17. 臨床成績 17. 1 有効性及び安全性に関する試験 17. 1. 1 国内第Ⅲ相試験① ドライアイ等に伴う角結膜上皮障害患者を対象に、人工涙液を 少なくとも 1 週間投与後、0.1%ヒアルロン酸ナトリウム点眼液又 は 2 %グルタチオン点眼液を 1 回 1 滴、1 日 5 回、両眼に 4 週間 投与した試験で有効性及び安全性を比較した。その結果、0.1% ヒアルロ...
https://www.senju.co.jp/system/files/product_other_file/2022-06/HAL_C8_20220701_0.pdf






