「24時間」の検索結果
134件:126~130件目を表示
-

ロメワン
フ ロ キ サ シ ン 濃 度 0 5 10 虹彩毛様体 水晶体 硝子体 網脈絡膜 視神経 血 清 ロ メ フ ロ キ サ シ ン 濃 度 1/4時間後 1/2時間後 1時間後 2時間後 6時間後 24時間後 (㎍/g or mL tissue) (㎍/g or mL tissue) Staphylococcus intermedius Staphylococcus intermedius 2....
https://www.senju.co.jp/system/files/2025-07/lomewon_202504_096-016.pdf -
千寿製薬
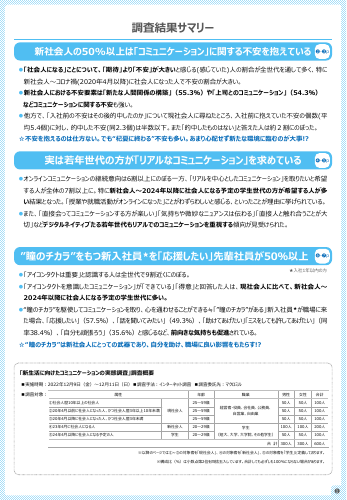
「社会人になる」ことについて、「期待」より「不安」が大きいと感じる(感じていた)人の割合が全世代を通して多く、特に 新社会人~コロナ禍(2020年4月以降)に社会人になった人で不安の割合が大きい。 新社会人における不安要素は「新たな人間関係の構築」(55.3%)や「上司とのコミュニケーション」(54.3%) などコミュニケーションに関する不安も強い。 他方で、「入社前の不安はその後的中したの
https://www.senju.co.jp/consumer/mytear/img/special/freshman/01/Survey_spring_programpage.pdf -

2021 年 7 改訂(第 12 版) 日本標準商品分類番号 87 1319 医薬品インタビューフォーム 日本病院薬剤師会のIF記載要領 2018(2019 年更新版)に準拠して作成 剤 形 ミケラン点眼液 1%: 水性点眼液 ミケラン点眼液 2%: 水性点眼液 製 剤 の 規 制 区 分 該当しない 規 格 ・ 含 量 ミケラン点眼液 1%: 1mL 中 カルテオロール塩酸塩 10mg ミケラン
https://www.senju.co.jp/system/files/2021-07/20210705_MK_IF.pdf -

2021 年 7 改訂(第 12 版) 日本標準商品分類番号 87 1319 医薬品インタビューフォーム 日本病院薬剤師会のIF記載要領 2018(2019 年更新版)に準拠して作成 剤 形 ミケラン点眼液 1%: 水性点眼液 ミケラン点眼液 2%: 水性点眼液 製 剤 の 規 制 区 分 該当しない 規 格 ・ 含 量 ミケラン点眼液 1%: 1mL 中 カルテオロール塩酸塩 10mg ミケラン
https://www.senju.co.jp/system/files/2021-07/20210705_MK_IF_0.pdf -

2024 年 1 月改訂(第 5 版) 日本標準商品分類番号 871319 医薬品インタビューフォーム 日本病院薬剤師会のIF記載要領 2018(2019 年更新版)に準拠して作成 剤 形 水性点眼剤 製 剤 の 規 制 区 分 処方箋医薬品(注意-医師等の処方箋により使用すること) 規 格 ・ 含 量 1mL 中カルテオロール塩酸塩 20mg、ラタノプロスト 50μg を含有 一 般 名 和名:
https://www.senju.co.jp/system/files/2024-01/Mikeluna_IF_20240111.pdf






